肿瘤免疫治疗巨头百时美施贵宝(BMS)近日宣布,美国食品药品监督管理局(FDA)已批准Opdivo(nivolumab,3mg/kg)联合低剂量Yervoy(ipilimumab,1mg/kg),用于既往接受3种标准化疗方案(氟嘧啶、奥沙利铂、伊立替康)后病情进展的微卫星不稳定性高(MSI-H)或DNA错配修复缺陷(dMMR)转移性结直肠癌儿科患者(12岁及以上)和成人患者的治疗。此次批准是基于总缓解率(ORR)和缓解持续时间(DOR)而加速批准。针对该适应症的进一步批准将取决于验证性研究中的临床受益的确证和描述。
此前,FDA已授予Opdivo+Yervoy组合治疗上述适应症的突破性药物资格和优先审查资格。此次批准,使Opdivo+Yervoy组合成为治疗MSI-H/dMMR mCRC的首个免疫(I-O/I-O)组合疗法。Opdivo(靶向PD-1)和Yervoy(靶向CTLA-4)分别靶向不同但却互补的免疫通路,将2者进行科学合理地组合并用于生物标志物选择的患者群体,有望改善患者的临床受益。
治疗MSI-H/dMMR mCRC方面,该组合推荐的给药方案为Opdivo+低剂量Yervoy(Opdivo剂量3mg/kg,静脉输注30分钟以上,之后进行Yervoy剂量1mg/kg,静脉输注30分钟以上,每3周一次,治疗4次),随后是Opdivo维持治疗(240mg,静脉输注30分钟以上,每2周一次),直至病情进展或不可接受的毒性。
值得一提的是,MSI-H/dMMR mCRC也是Opdivo+Yervoy组合获批的第三种肿瘤类型。之前,该组合已获准用于其他2种肿瘤类型:
(1)Opdivo(3mg/kg)+低剂量Yervoy(1mg/kg)组合获批治疗先前未接受治疗的(初治的)中高危晚期肾细胞癌(RCC)患者;
(2)Opdivo(1mg/kg)+Yervoy(3mg/kg)组合基于无进展生存数据已获加速批准治疗不可切除性或转移性黑色素瘤。此外,Opdivo作为单药疗法也已获批用于既往接受氟嘧啶、奥沙利铂和伊立替康化疗后病情进展的MSI-H或dMMR mCRC儿科患者(12岁及以上)和成人患者的治疗,该批准基于ORR和DOR数据。
此次MSI-H/dMMR mCRC适应症的获批,是基于一项正在开展的II期临床研究CheckMate-142的数据。该研究中包括一个Opdivo+Yervoy组合队列,该队列入组了119例dMMR或MSI-H mCRC患者,其中82例(占比69%)既往已接受基于氟嘧啶、奥沙利铂、伊立替康的化疗方案治疗期间或治疗后病情进展。该队列中,患者接受Opdivo(3mg/kg)和Yervoy(1mg/kg)治疗,每3周一次,治疗4次,之后接受每2周一次Opdivo(3mg/kg)单药治疗。研究中,患者持续接受治疗,直至不可接受的毒性或放射学进展。在前24周,每6周对肿瘤进行一次评估,之后每12周对肿瘤进行一次评估。该队列的疗效预后评价指标包括ORR和DOR,由独立放射学审查委员会(IRRC)根据实体瘤疗效评价标准1.1版(RECIST v1.1)评估。
数据显示,在既往接受氟嘧啶、奥沙利铂、伊立替康治疗的82例患者中,Opdivo+Yervoy治疗的ORR为46%(95%CI:35-58,n=38/82),其中完全缓解率为3.7%(n=3/82),部分缓解率为43%(n=35/82)。实现缓解的这38例患者中,中位DOR尚未达到(范围:1.9个月--23.2+个月),89%的患者DOR≥6个月,21%的患者DOR≥12个月,目前该队列仍在继续进行评估。
此外,在入组的全部119例患者中,Opdivo+Yervoy治疗的ORR为49%(95%CI:39-58,n=58/119),其中完全缓解率为4.2%(n=5/119),部分缓解率为45%(n=53/119)。实现缓解的这58例患者中,中位DOR尚未达到(范围:1.9个月—23.2+个月),83%的患者DOR≥6个月,19%的患者DOR≥12个月。在数据库锁定时,这58例患者中有51例患者仍继续保持缓解。
Opdivo+Yervoy组合队列中,有86%的患者接受了4剂Opdivo+Yervoy治疗,因不良反应导致的Opdivo中断率为13%、Opdivo延迟给药率为45%,严重不良反应发生在47%的患者中。最常见的不良反应(发生率≥20%)包括疲劳(49%)、腹泻(45%)、发热。(36%)肌肉骨骼疼痛(36%)、腹痛(30%)、瘙痒(28%)、恶心(26%)、皮疹(25%)、食欲下降(20%)、呕吐(20%)。最常见的严重不良反应(发生率≥2%)包括结肠炎/腹泻、肝事件、腹痛、急性肾损伤、发热和脱水。
CheckMate-142研究的首席研究员、南加州大学KKE医学院胃肠肿瘤研究中心Heinz-Josef Lenz教授表示,存在dMMR或MSI-H生物标志物的mCRC难以治疗,一些患者可能需要额外的选择。FDA批准Opdivo+Yervoy免疫组合为我们提供了一种令人鼓舞的方法,帮助解决既往接受三种标准化疗方案治疗后病情进展的MSI-H/dMMR mCRC患者群体中存在的这一极具挑战性的疾病。
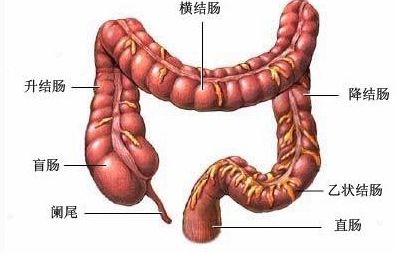
结肠直肠癌(CRC)是一种病发部位位于结肠或直肠的癌症,而结肠或直肠是身体消化或胃肠道系统的一部分。在美国,CRC是第三种最常见的癌症类型,2018年预计将有14万新病例被确诊,这将使CRC成为美国癌症相关死亡的第三大病因。
DNA错配修复缺陷(dMMR)发生在负责修复DNA复制错配错误的蛋白质缺失或无功能的情况下,导致在某些类型癌症(包括CRC)中产生MSI-H肿瘤。据估计,大约有15%的CRC患者和4%-5%的mCRC患者存在dMMR或MSI-H生物标志物。dMMR或MSI-H mCRC患者不大可能受益于常规化疗方案,通常预后非常差,存活率也低。因此,应对所有CRC患者进行dMMR或MSI-H状态的常规检查。

本文转载自其他网站,不代表健康台观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:jkcentv@163.com)
责任编辑:邹林梅


相关文章